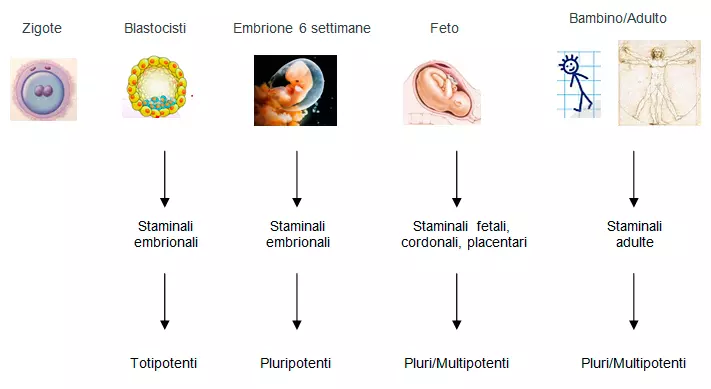
Nel midollo osseo si trovano, in uno stato di quiescenza, in nicchie emopoietiche assieme ad osteoblasti.
Le nicchie forniscono un microambiente protettivo che garantisce il mantenimento e il rinnovamento delle cellule staminali emopoietiche midollari isolandole da stimoli differenziativi e proapoptotici.
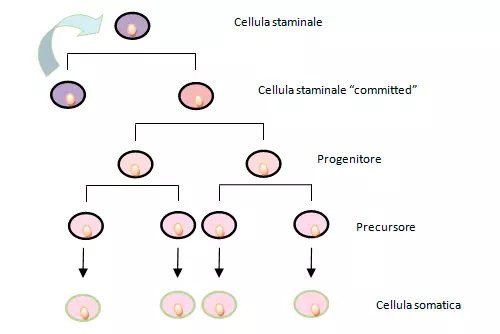
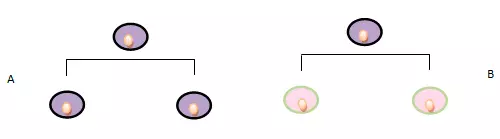
Dallo stato quiescente solo di rado le MSC entrano in mitosi compiendo una divisione cellulare asimmetrica: questo tipo di replicazione e il basso tasso di mitosi garantiscono sia uno stretto controllo del numero di cellule staminali sia la conservazione dell’integrità del genoma (il basso numero di replicazioni riduce il rischio di danni al DNA e successive mutazioni).
Le MSC sono in grado di migrare spontaneamente nei tessuti di origine ed anche selettivamente in tessuti danneggiati; tale fenomeno è indicato come “multiorgan homing capacity”.
Sebbene il meccanismo di reclutamento attraverso il quale avviene il passaggio dall’endotelio vascolare al tessuto non sia ancora pienamente compreso, è probabile che siano coinvolte chemochine e relativi recettori in qualità di fattori di controllo della migrazione cellulare.
In sede di danno tissutale promuovono la rigenerazione del tessuto compromesso mediante differenziamento e secrezione paracrina di fattori anti infiammatori.
Le MSC hanno spiccate proprietà immunoregolatorie: sono capaci di sopprimere reazioni immuni sia in vitro sia in vivo in modo indipendente dal complesso maggiore di istocompatibilità (MHC).
È stato dimostrato un effetto immunosoppressivo delle MSC attraverso un meccanismo che coinvolge tutte le popolazioni cellulari deputate alla risposta immunitaria, dai linfociti T, ai linfociti B , alle cellule NK ed alle cellule dendridiche di origine monocitaria.
La capacità immunosoppressiva delle MSC risulta presente in diverse specie animali, anche se con meccanismi solo parzialmente chiariti.
Data la capacità di modulare la risposta immunitaria e di promuovere la riparazione dei tessuti, l’uso delle MSC è stato proposto anche nel trattamento delle malattie autoimmuni, cioè condizioni patologiche che alterano il normale funzionamento del sistema immunitario provocando una reazione diretta contro il proprio organismo riconosciuto come non self.
La loro scarsa immunogenicità inoltre, permette di utilizzare in maniera intercambiabile MSC autologhe od allogeniche senza rischi apparenti per il ricevente.